Die letzte ÖGI Tagung fand im vergangenen November in der Universitätszahnklinik Wien statt. Mit dem Kongressthema „Risiko Management 2020 – Risiken erkennen, erfolgreich minimieren“ wurde der größte Teil der zahnmedizinisch-chirurgischen und implantologischen Behandlung in den Fokus gerückt.
Die Österreichische Gesellschaft für Implantologie ist die größte zahnmedizinische Fachgesellschaft Österreichs und die bedeutendste implantologische Plattform des Landes. Die jährlichen Kongresse der ÖGI enthalten neben Industrieworkshops, Ausstellungen mit etlichen Sponsoren auch spannende Live-Operationen mit bekannten Referenten und Implantologen. Dieses Mal wurde auch das neue Implantologie-Curriculum der ÖGI vorgestellt mit der Zielsetzung Ausbildungsstandards zu definieren und ab dem Wintersemester 2019/2020 eine neue strukturierte, implantologische Ausbildung anzubieten. Das aus acht Modulen bestehende Curriculum greift auf einen Pool bereits vorhandener Kurse zurück, die in sechs verschiedenen Ausbildungszentren (Innsbruck, Graz, Wien, Krems) angeboten werden. Jedes Modul hat seinen eigenen Themenschwerpunkt, wie z.B. Planung/Diagnostik, Medikation oder digitaler Workflow, und kann unabhängig voneinander gebucht werden. Abgerundet werden diese Module durch Humanpräparatkurse und Vorträge mit Implantologie-Mentoren, Zahntechniker und der Industrie. Abgeschlossen wird die Ausbildung mit einer mündlichen Prüfung und der Präsentation von fünf selbst behandelten Fällen.
 Der implantologische Behandlungsbedarf nimmt von Jahr zu Jahr zu und neben den traditionellen Indikationen und Therapien gibt es zunehmend innovative Konzepte, die beim ÖGI Kongress von Experten präsentiert und verglichen wurden. Die richtigen Risiken zu erkennen, erfordert ein Zusammenspiel aus den Faktoren Patient, Behandler und Material. Auch aus diesem Grund wurden die Vortragsreihen des Kongresses in diese namensgleichen Themenblöcke zusammengefasst. In der vorliegenden Dental Journal-Ausgabe werden einige Auszüge aus dem ersten Block „Risikofaktor Patient“ mittels den großen Krankheitsbereichen der rheumatoiden Arthritis und antiresorptiver Therapie vorgestellt. In der nächsten Ausgabe werden die Blöcke „Risikofaktor Behandler“, „Risikofaktor Material“ und Peri-Implantitis näher beleuchtet.
Der implantologische Behandlungsbedarf nimmt von Jahr zu Jahr zu und neben den traditionellen Indikationen und Therapien gibt es zunehmend innovative Konzepte, die beim ÖGI Kongress von Experten präsentiert und verglichen wurden. Die richtigen Risiken zu erkennen, erfordert ein Zusammenspiel aus den Faktoren Patient, Behandler und Material. Auch aus diesem Grund wurden die Vortragsreihen des Kongresses in diese namensgleichen Themenblöcke zusammengefasst. In der vorliegenden Dental Journal-Ausgabe werden einige Auszüge aus dem ersten Block „Risikofaktor Patient“ mittels den großen Krankheitsbereichen der rheumatoiden Arthritis und antiresorptiver Therapie vorgestellt. In der nächsten Ausgabe werden die Blöcke „Risikofaktor Behandler“, „Risikofaktor Material“ und Peri-Implantitis näher beleuchtet.
Rheumatoide Arthritis und Implantate, geht das überhaupt?
Wenn es um systemisch entzündliche Erkrankungen wie bei der rheumatoiden Arthritis (RA) geht, dann ist bei einer Implantation und einem späteren Langzeiterfolg besondere Vorsicht geboten. OA Priv. Doz. Dr. Stephan Acham (Graz) beschrieb im ersten Vortragsblock „Risikofaktor Patient“ neben direkten Krankheitsfolgen auch die Nebenwirkungen durch die RA-Medikamente sowie den sekundären Krankheitsfolgen.
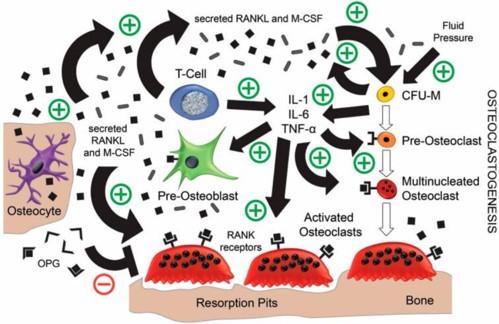
Knochen- und Weichgewebsheilungen verlaufen unter einer rheumatoiden Arthritis anders. Als Konsequenzen werden in der Literatur eine Alteration in der Knochendichte, erhöhte Entzündungsbereitschaft und verzögerter Weichgewebsheilung von Bindegewebe und Gefäßen beschrieben. In einem gesunden, ossären Zustand befindet sich eine Balance zwischen Knochenauf- und -abbau. Bei einer RA ist diese Balance in einer Schieflage, da die osteoklastische Aktivität zunimmt und mit einer erhöhten Resorption des periimplantären Gewebes durch eine Entzündung gerechnet werden muss (siehe Abbildung 1).
RA und Medikamente
Der Sinn der Gabe spezifischer Medikamente bei rheumatischer Arthritis ist die ossäre Schieflage der Entzündungsreaktion wieder in ein Gleichgewicht zu rücken. Die durch die Gabe der meisten rheumatischen Medikamente auftretenden Konsequenzen können fortwährende Risiken durch opportunistische Infektionen sein (à ev. AB Gabe präoperativ), ein weiteres perioperatives Risiko stellen Wundheilungsstörungen dar und als nachhaltige Risiken werden z.B. Bisphosphonate angeführt. Bei den meisten RA Medikamenten kann von einer gewissen Latenzzeit ausgegangen werden. Ein weiterer wichtiger Punkt ist eine mögliche Potenzierung des Risikos durch die Kombination von Kortikosteroiden und Anti-Resorptiva die mit Kiefernekrosen einhergehen kann.
Bei Gabe von Kortikosteroiden (z.B. Prednisolon) im Rahmen einer RA Therapie ist es essenziell, die Einnahme für eine implantologische Behandlung nicht zu unterbrechen und konstant weiterzuführen, da es zu einem Krankheitsschub kommen kann.
Für die neuen Rheuma Medikamente DMARDs (Disease-modifiying antirheumatic drugs) gibt es perioperative Empfehlungen [Gualtierotti R et al. Perioperative Management of Patients with Inflammatory Rheumatic Diseases Undergoing Major Orthopaedic Surgery: A Practical Overview. Adv Ther (2018)]:
- csDMARDs (MTX, Hydrochloroquin, Sulfasalazin, Cyclosporin)
- Schwere RA: Fortsetzen d. Medikation
- Nicht-schwerwiegende RA: Unterbrechen 1 Wo prä- bis 3-5 d post op.
- tsDMARDs (= JAKinibe, Baricitinib [Olumiant])
- Unterbrechen 1 Wo prä- bis 2 Wo post op.
- bDMARDs (Etanercept [Enbrel], Abatacept [Orencia], Infliximab [Remicade, Inflectra], usw.)
- OP am Ende eines Dosierungszyklus planen, wenn es keine Komplikationen gibt mit Gabe 2 Wo post op. Fortsetzen.
Vertiefendes respektive Handlungsempfehlungen finden sich online unter https://www.st-josef-stift.de/media/Pdf/Kliniken/RO_Rheumaorthopaedie/Rheumaorthopaedie-St-Josef-Stift-Periop_Management_2018.pdf)
Sekundäre Krankheitsfolgen
Patienten mit rheumatischen Erkrankungen leiden nicht nur an der Diagnose und der ständigen Medikamenten-Einnahme daran, sondern sind im Alltag deutlich gehandicapt. Dazu gehören Xerostomie, SH-Befall (Mucositis, Karies) und Einschränkung manueller Fertigkeiten (Kraft, Geschicklichkeit). Zu vermeiden sind somit chronische Entzündungen wie periimplantäre Erkrankung, die auch ohne Einsatz von Antiresorptiva zu Nekrosen führen können. Deswegen ist eine gewissenhafte Patientenselektion unumgänglich.
Sind Implantate bei Patienten mit einer rheumatoiden Arthritis geeignet und was muss man beachten?
- Implantate sind bei RA keinesfalls kontraindiziert, wenn man folgende Punkte beachtet: Augmentationen vermeiden, Zahl der Eingriffe geringhalten und geschlossene Einheilung
- Strenge Patientenselektion in Abhängigkeit des Krankheitsverlaufs (SH-Befall? Mundtrockenheit? Etc.)
- Individuelle patienten-zentrierte Planung (manuellen Fähigkeiten des Patienten)
- Interdisziplinäre Behandlungsplanung (Rheumatologe)
- Sensibilisierung und stringente Entzündungskontrolle
Antiresorptive Medikamente
Im nächsten Vortrag präsentierte Prof. Dr. Andreas Stavropolous (Malmö) die alten und neuesten Erkenntnisse antiresorptiver Medikamente. Ein beträchtlicher Teil der erwachsenen Bevölkerung wurde/wird mit antiresorptiven Medikamenten (ARDs) behandelt. Es ist daher relevant, mögliche Nebenwirkungen der Einnahme von ARDs im Zusammenhang mit verschiedenen Aspekten der Implantattherapie zu beurteilen. Unter antiresorptiven Medikamenten versteht man eine Gruppe von Substanzen, die über eine Osteoklastenhemmung den systemischen und lokalen Knochenabbau reduzieren. Aufgrund dieses Wirkungsmechanismus sind die Medikamente bei Erkrankungen indiziert, die mit einer erhöhten Knochenresorption einhergehen. Dazu zählen primäre und sekundäre Formen der Osteoporose, angeborene Knochenerkrankungen, wie Morbus Paget oder Osteogenesis imperfecta, primäre Knochentumore, wie das Plasmozytom oder ossäre Metastasen solider Tumore, die insbesondere bei Mamma- und Prostatakarzinomen, aber auch bei Nieren- oder Lungentumoren vorkommen. Aus diesem Indikationsspektrum ergibt sich eine hohe Verordnungsprävalenz antiresorptiver Medikamente.
Bisphosphonate sind Analoge zu natürlichen Pyrophosphaten und haben eine hohe Affinität zum Hydroxylapatit des Knochens und eine hemmende Wirkung auf Osteoklasten. Bisphosphonate sind stabiler als Pyrophosphate und können enzymatisch nicht gespalten werden und sind länger bioverfügbar. Die unterschiedlichen Bisphosphonatgruppen haben ein gemeinsames Grundgerüst und unterscheiden sich in ihren Seitenketten. Diese Seitenketten bestimmen Knochenaffinität und den Umfang der Osteoklastenhemmung (antiresorptive Potenz). Bisphosphonat kann oral (p.o.) oder intravenös (i.v.) verabreicht werden, wobei die Bioverfügbarkeit oral eingenommener deutlich geringer ist als bei intravenöser Applikation. Bisphosphonate lagern sich am Hydroxylapatit der Knochenoberfläche, werden von Osteoklasten aufgenommen und hemmen über intrazelluläre Prozesse deren Aktivität. Nach ein paar Wochen werden diese in die Knochenmatrix eingebaut und verbleiben einige Jahre. Aus diesem Grund zahlt sich eine sog. „drug holiday“ gar nicht aus. Gleichzeitig hemmen Bisphosphonate die Gefäßneubildung (Neoangiogenese) im Knochen, sodass die Knochendurchblutung reduziert und dadurch die ossäre Regenerationsfähigkeit verringert wird. Insgesamt resultiert aus der Bp-therapie ein stärker mineralisierter, gefäßarmer und abwehrgeschwächter Knochen.
Denosumab
Der monoklonale Antikörper Denosumab (Prolia; XGEVA) wird neben BPs seit einigen Jahren zur antiresorptiven Behandlung eingesetzt (> 40% der Behandlungen von Osteoporose). Denosumab wird subkutan verabreicht und hemmt über eine RANK-L/RANK-Interaktion ebenfalls die Aktivität von Osteoklasten, sprich es wird verhindert, dass Osteoklasten gebildet werden. Anders als BP bindet der Antikörper jedoch nicht an der Knochenoberfläche, sondern verteilt sich im Interzellularraum der Osteoklasten und entfaltet von dort aus seine antiresorptive Wirkung. Denosumab wird auch nicht in die Knochenmatrix eingebaut, sodass der Therapieeffekt nach sechs Monaten vollständig reversibel ist. Indikationen monoklonaler Antikörper können Osteoporose, Knochenmetastasen oder Prostatakarzinome sein. Die Plasmahalbwertszeit beträgt ca. 26 Tage.
Medikament-induzierte Kiefernekrosen (MRONJ)
Antiresorptive Medikamente (z.B. Pamidronat, Zoledronat) haben ein Nebenwirkungsprofil, welches sich als Kiefernekrosen im Kiefer fundiert. Durch die Medikamenten-induzierte verminderte Stoffwechsel- und Abwehrleistung des Knochens kann es zur Nekrotisierungen im Kiefer kommen und durch sekundäre Besiedlungen von Bakterien kann es in weitere Folge zu ausgedehnten, therapieresistenten Knochenläsionen führen. Eine mikrobielle Kontamination des Knochens kann dabei sowohl durch Keimverschleppung, als auch durch direkte Besiedlung freiliegender Knochenareale aufgrund von z.B. Prothesendruckstellen oder Extraktionalveolen erfolgen. Da Kiefernekrosen auch nach der Therapie mit Denosumab beschrieben wurden, hat sich in der Literatur die Bezeichnung Medication-releated Osteonecrosis of the Jaw (MRONJ) für die Nebenwirkung am Kiefer durchgesetzt.
Die MRONJ ist definiert als eine länger als acht Wochen bestehende Knochendenudation bei anamnestisch bekannter antiresorptiver Therapie und Ausschluss einer tumortherapeutischen Bestrahlung im Kopf-Hals-Bereich. Neben dem Kardinalsymptom freiliegender Knochen können sich die Kiefernekrosen mit Rötungen, Schwellungen sowie Abszess- und Fistelbildung an der umgebenden Schleimhaut manifestieren. Ein häufiges Symptom ist außerdem das s.g. Vincent-Phänomen, eine Hypästhesie im Ausbreitungsgebiet des Nervus alveolaris inferior. Im fortgeschrittenen Stadium können Zahnlockerungen, Sequesterbildung und pathologische Frakturen auftreten.
MRONJ sollte differentialdiagnostisch von einer Ostitis, Sinusitis, Gingivitis oder Parodontitis unterschieden werden. Klinisch ähnelt eine MRONJ einer Osteomyelitis mit untypischen Beschwerden wie beispielsweise lockeren Zähnen, geschwollener Mukosa und/oder Parästhesien/Anästhesien z.B. nach Zahnextraktionen.
Antiresorptive Medikamente und Implantate, geht das überhaupt?
Dutzende Studien über Bisphosphonat-Therapien (hauptsächlich niedrige Dosen zur Osteoporosebehandlung) zeigten keine beträchtlichen Unterschiede bei Implantatüberlebensraten oder die periimplantären marginalen Knochenverhältnisse im Vergleich zu Kontrollgruppen ohne BP-Therapie. Nur wenige Studien kamen zu dem Resultat, dass es in 70% der Fälle nach ca. 36 Monaten nach Beginn der Einnahme von antiresorptiven Medikamenten zu einer Kiefernekrose (MRONJ) kam. Im Allgemeinen lässt sich festhalten, dass eine niedrig dosierte orale BP-Einnahme zur Osteoporosebehandlung eine Implantattherapie nicht beeinträchtigt. Das ONJ-Risiko ist auch bei einer primären Osteoporose mit intravenöser Medikation gering. Es gibt wenige Informationen über mögliche Auswirkungen hochdosierter BPs oder monoklonaler Antikörper (z.B. Denosumab) auf Implantate oder gar den Erfolg von Augmentationen. Patienten mit hochdosierten ARDs zur Behandlung bösartiger Tumore (zB Mamma- oder Prostata-Karzinom), oder Patienten mit oralen BPs über einen längeren Zeitraum und Patienten mit Komorbiditäten, sollten als Hochrisikopatienten für MRONJ betrachtet werden. Sogar innerhalb des onkologischen Patientenkollektives mit i.-v.-BP-Medikation finden sich relevante Unterschiede zwischen der prophylaktischen BP-Gabe ohne ossäre Metastasierung gegenüber therapeutischer BP-Gabe bei manifesten Metastasen bezüglich der BP-Dosis und Applikationsintervalle und somit auch bezüglich des ONJ-Risikos.
Um Risiken für Implantate überschaubarer zu gestalten, präsentierte Prof. Stavropolous sog. Risk-staging Charts:
Low risk:
- Bei primärer Osteoporose
- nicht aminohaltige BP àB. Clondronat
- oral oder i.v. ca. 12 Monate
- Halbwertszeit < 3 Jahre
- Bei Denosumab: 60mg ca. 12 Monate (Prolia)
Medium risk:
- Sekundäre / therapieinduzierte Osteoporose, solide Tumore (keine Knochenmetastasen, Komorbiditäten/Medikamente
- v. ca. 6 Monate
- Halbwertszeit 3-6 Jahre
High risk:
- solide Tumore mit Knochenmetastasen, Multiples Myelom / Plasmozytom
- Aminohaltige BP à Zoledronat, Ibandronat, Alendronat
- v. ca. 1 Monat
- Halbwertszeit > 6 Jahre
- Bei Denosumab: 120mg ca. 1m (XGeva)
Für die Indikationsfindung einer Implantation bei Patienten mit AR Therapie (BP oder Denosumab) hat das Risiko einer Kiefernekrose (ONJ) eine große Relevanz. Um die Risiko-Evaluation vor Implantation für den Behandler übersichtlicher zu gestalten hat die DGI einen „DGI-Laufzettel“ unter https://www.dginet.de/web/dgi/laufzettel-bisphosphonate als Pdf veröffentlicht.